FoundationOne Liquid CDx
Gehen Sie einen Schritt weiter!
Für alle Ihre Patienten mit soliden Turmoren ist jetzt die validierte und zertifizierte Liquid Biopsy (aus Blut) von Foundation Medicine verfügbar.
Die minimal-invasive NGS-Analyse kann als Alternative oder komplementär zur Gewebeprobe eingesetzt werden und Sie bei der Therapiefindung unterstützen.

Schnelle und einfache Lösung mit nur einer Blutprobe

Geeignet für alle Patienten mit soliden Tumoren
Umfasst von Leitlininen empfohlene und andere klinisch relevante genomische Alterationen und Signaturen.2,3,12-31
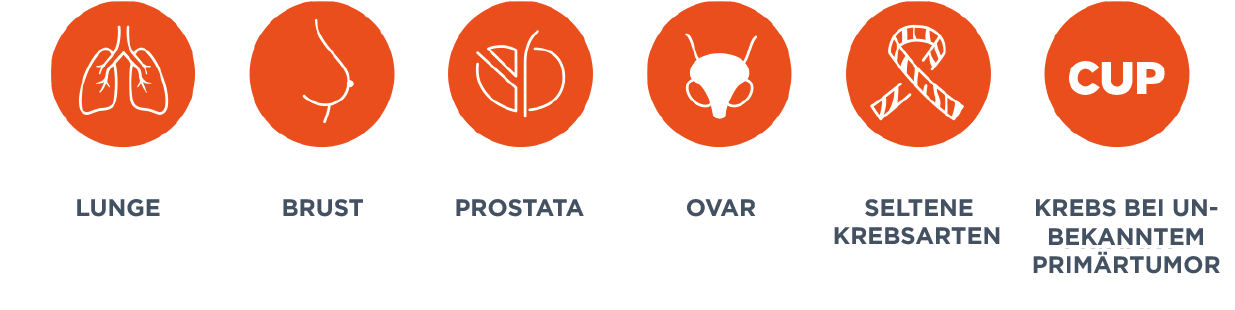
Kann die klinische Entscheidungsfinung unterstützen
Der Assay umfasst klinisch Relevante und von Leitlinien empfohlene genomische Alterationen, welche die Therapiefindung für Patienten unterstützen können.1-5
Weitere Informationen zu FoundationOne Liquid CDx kommen bald. Bei Fragen können Sie gerne unser Team oder Ihren Roche-Ansprechpartner kontaktieren.
*Basensubstitutionen, Insertationen und Deletionen, Kopiezahlvariationen, Rekombinationen
†309 Gene mit vollständiger Exon-Abdeckung (codierend) und 15 Gene mit ausgewählter nicht-codierender Abdeckung.
‡FoundationOne Liquid CDx detektiert MSI-H Status
§75 Gene werden mit erhöhter Sensitivität und mit vollständiger Exon-Abdeckung (codierend) erfasst;
¥Die klinische Validierung basiert auf Evidenz welche mit einer früheren Liquid Biopsy Version von Foundation Medicine gewonnen wurde. Für vollständige Konkordanzergebnisse zwischen den beiden Assays stehen Informationen auf www.foundationmedicine.com/F1LCDx zur Verfügung
Abkürzungen:
bTMB: Tumormuationslast aus Blut; CDx: Companion Diagnostic; FDA: U.S. Food and Drug Administration; MSI: Mikrosatelliteninstabilität; NGS: Next Generation Sequencing.
- FoundationOne Liquid CDx FDA Approval, 2020. Available at: https://www.foundationmedicine.com/press-releases/445c1f9e-6cbb-488b-84ad-5f133612b721 (Accessed August 2020).
- Data on file: FoundationOne Liquid CDx Technical Specifications, 2020. Available at: http://www.eifu.online/FMI/190070862 (Accessed August 2020).
- Data on file: Clinical and analytical validation data file for FoundationOne Liquid CDx.
- FoundationOne CDx FDA Approval, 2017. Available at: https://www.fda.gov/medical-devices/recently-approved-devices/foundationone-cdx-p170019 (Accessed August 2020).
- FoundationOne CDx Technical Information, 2018. Available at: www.rochefoundationmedicine.com/f1cdxtech (Accessed August 2020).
- Gadgeel SM et al. Ann Oncol 2019; 30: S5; v851–v934; presented at ESMO 2019.
- Lebel S et al. J Psychosom Res 2003; 55: 437–443.
- Hayes et al. J Health Psychol 2017; 22: 561–571.
- Francis G, Stein. Int J Mol Sci 2015; 16: 14122–14142.
- Siravegna G et al. Ann Oncol 2019; 30: 1580–1590.
- Data on file: FoundationOne Liquid CDx Specimen Instructions.
- Planchard D et al. Ann Oncol 2019; 30: 863−870.
- NCCN Clinical Practice Guidelines in Oncology. Non-Small Cell Lung Cancer. Version 6.2020, June 2020. Available at: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf (Accessed August 2020).
- Cardoso F et al. Ann Oncol 2019; 30: 1194−1220.
- NCCN Clinical Practice Guidelines in Oncology. Breast Cancer. Version 5.2020, July 2020. Available at: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf (Accessed August 2020).
- NCCN Clinical Practice Guidelines in Oncology. Prostate Cancer. Version 2. 2020, May 2020. Available at: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf (Accessed August 2020).
- Parker C et al. Ann Oncol 2020; 31: 1119–1134.
- NCCN Clinical Practice Guidelines in Oncology. Ovarian Cancer. Version 1.2020, March 2020. Available at: https://www.nccn.org/professionals/physician_gls/pdf/ovarian.pdf (Accessed August 2020).
- Colombo N et al. Ann Oncol 2019; 30: 672−705.
- Khagi Y et al. Clin Cancer Res 2017; 23: 5729–5736.
- Gandara DR et al. Nat Med 2018; 24: 1441–1448.
- Abida W et al. JAMA Oncol 2019; 5: 471–478.
- Mateo J et al. Eur Urol 2017; 71: 417–425.
- Socinski M. Ann Oncol 2019; 30: v851–v934.
- Kok M et al. ESMO Open 2019; 4(Suppl 2): e000511.
- Zhao P et al. J Hematol Oncol 2019; 12: 54.
- Pikor LA et al. Lung Cancer 2013; 82: 179–189.
- Tsao AS et al. J Thorac Oncol 2016; 11: 613–638.
- Sanchez-Vega F et al. Cell 2018; 173: 321–337.e10.
- Kroeger PT Jr. et al. Curr Opin Obstet Gynecol 2017; 29: 26–34.
- Amatu A et al. ESMO Open 2016; 1:e000023.
- FDA approves pembrolizumab for adults and children with TMB-H solid tumors, 2020. Available at: https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-pembrolizumab-adults-and-children-tmb-h-solid-tumors (Accessed August 2020).
- Marabelle A et al. Ann Oncol. 2019;30(suppl_5):v475-v532.
- Yarchoan M et al. JCI Insight 2019; 4: e126908.